Proteintech 抗體更上層樓,超凡的奈米抗體 ChromoTek!
2020年10月底,傳統抗體生產商Proteintech group.全資收購德國羊駝奈米抗體巨頭ChromoTek,引起了整個生物行業的關注,同年11月初,來自來自美國匹茲堡大學的研究人員開發出一種從美洲駝(Llama)身上提取的SARS-CoV-2奈米抗體,可製成常溫儲存使用的氣霧劑以預防和治療COVID-19 ,引發民眾熱議。
這兩個事件中的主角 ── 奈米抗體,究竟是何方神聖呢?
.png)
(照片取自ChromoTek IG)
一、奈米抗體的發展史
自1975年小鼠雜交瘤技術問世以後,單克隆抗體(monoclonal antibodies,mAbs)研究突飛猛進,憑藉特異性高、均一性好...等特點,與傳統從血清中提取的多克隆抗體(polyclonal antibodies, pAbs)形成了雙雄對峙局面,二者實力不分伯仲,在不同的應用領域中各有優劣。
然而隨著時間推移,科學家發現不管是單、多克隆抗體,其分子似乎都......太大了。150kDa左右的免疫球蛋白對於愈發精細、準確的科學試驗和藥物研發而言,是一個不小的阻礙。空間佔位大、容易引起免疫反應、無法穿透血腦屏障......弊端開始顯現。
科學家開始尋找更小的抗體√
1988年,Skerra等科學家[1]首次運用基因工程技術設計並改造抗體基因結構,成功獲得了功能性單鏈可變區抗體片段(single-chain variable fragment,scFv)(下圖)。scFv保留了識別與結合抗原的能力。並且丟掉了重鏈恆定區片段(Fc),不僅免疫原性低,不與細胞膜上Fc受體結合,而且分子小(約25kDa),可以穿過血腦屏障,大大擴展了抗體的應用前景。遺憾的是基因工程改造出的scFv在穩定性上有所欠缺,還有待進一步改造升級。
.png)
圖片來源於引用文獻[11]
1989年,來自布魯塞爾自由大學(VUB)的Hamers-Casterman等人[2]在一次實驗中偶然發現,單峰駝血液中有相當數量的抗體缺失了輕鏈,為確保這個結果的準確性,該團隊成員多次重複實驗,結果依舊。單峰駝的血液中真實存在天然的輕鏈缺失抗體,也被稱作重鏈抗體(heavy-chain antibodies,HcAbs) (下圖)。
.png)
圖片來源於引用文獻[11]
HcAbs雖然丟失了輕鏈(原因有待探究),但其對抗原的識別能力仍在。HcAbs的重鏈可變區片段(variable domain of heavy chain of heavy-chain antibody,VHH)以更小的軀體,發揮著傳統抗體Fab段的完整作用。
目前所發現的駱駝科動物(駱駝屬、羊駝屬、小羊駝屬)血清中均同時存在HcAbs(IgG2/IgG3)和傳統IgG(IgG1),只是二者所佔的比例在不同動物中不盡相同,在羊駝和小羊駝屬中,HcAbs的比例約11%[3]。
1997年,Ghahroudi等[4]利用噬菌體展示技術獲得駱駝重鏈可變區片段VHH基因庫,經多輪淘選後得到了只含有一個結構域的最小單元抗原結合片段,被稱為單域抗體(single-domain antibodies,sdAbs) (上圖)。這種橢球形的小分子抗體的直徑僅2.5nm,長4nm,相對分子量僅15kDa,是傳統抗體的十分之一,因此也被稱為奈米抗體(nanobodies,Nbs) 。
二、奈米抗體的應用優勢
奈米抗體作為已知的能夠與抗原結合的最小功能單位,被視為最新一代的抗體工具,一顆冉冉升起的新星。在科學實驗和抗體藥物研發方面,除去高特異性、高親和力等優點,奈米抗體還有著兩個傳統抗體不可比擬的優勢:
1. 分子量小
分子量小是奈米抗體的立足之本。基於小分子量,奈米抗體在以下方面展現出優勢:
- 穿透能力強:在生命科學研究方面,奈米抗體可以穿越細胞質膜,適合作為細胞內抗體標靶胞內乃至核內蛋白,例如ChromoTek的一種特殊胞內抗體Chromobody®,將奈米抗體與螢光蛋白融合,可以用於實時監測胞內生化過程[5];在醫學研究方面,奈米抗體能夠穿透血腦屏障,為大腦中疾病的研究及治療提供新方法;同時有著更短的半衰期能從腎小球濾過,從血清中被清除;並且奈米抗體還可進入緻密組織內部,是標靶藥物的理想材料[6]。
- 免疫原性弱:也就是較不容易引起宿主免疫反應,免疫原性與分子量及蛋白結構等有關,分子量越小免疫原性越小。奈米抗體分子量僅有傳統抗體的1/10,因此刺激有機體形成特異性抗體或引起體液和細胞免疫反應機率大大降低。同時,奈米抗體無Fc段,避免了Fc引起的補體反應,對人體免疫原性很低,生物相容性較好[7]。
- 空間佔位小:奈米抗體的小個頭允許它結合到抗原的各個位置,包括一些凹陷的、不易暴露的表位,有助於提高抗體的特異性和親和力;同時也允許一個抗原結合更多的奈米抗體,對生物信號有一個極強的放大作用,提高檢測靈敏度;並且由於抗體更小導致的空間位移更小,所觀察到的訊號位置也會更加準確。此外空間佔位小也讓奈米抗體可輔助不穩定蛋白折疊,2012年諾貝爾化學獎獲得者因首次捕獲到G蛋白偶聯受體(GPCR)活化構象而獲獎,其中的大功臣便是奈米抗體[8]。
- 可雕塑性強:奈米抗體作為一個15kDa左右的蛋白,分子量大小甚至小於常用的GST Tag(26kDa),因此奈米抗體的改造與融合也是相對容易的;還是以ChromoTek為例,基於奈米抗體開發出了一系列的產品:與磁珠或Agarose等基質相連,推出可捕獲蛋白的Nano-Trap系列;與GFP等螢光蛋白基因融合形成胞內探針Chromobody®系列;與AF488等螢光染劑結合形成螢光探針Nano-Boosters & Nano-Labels系列。
- 表達純化簡單:奈米抗體由單一基因編碼、結構簡單,是一個典型的β折疊桶(下圖),適合於噬菌體、大腸桿菌、酵母等各種表達系統進行高效表達與純化,並且獲得具有生物活性的蛋白分子。
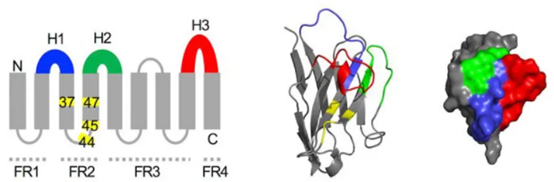
圖片來源於引用文獻[12]
2. 穩定性高
奈米抗體的另一個巨大優勢便是它的穩定性。奈米抗體氨基酸序列相較於傳統抗體的VH片段有四個關鍵位點的突變,使其親水性增加,溶解性增加,不會像傳統抗體一樣容易出現聚集現象。
奈米抗體內部具有非典型雙硫鍵使其抗熱性和化學穩定性變得極強,奈米抗體的變性溫度在變性溫度在70℃~80℃之間[9] ,部分源自鯊魚的奈米抗體即便在95℃下加熱一小時,依舊能保持一定活性!
抗熱性也是文章開頭提到的SARS-CoV-2奈米抗體藥物能夠在常溫使用和保存的根本原因。此外,奈米抗體在2.3~3.3M的Guanidine Hydrochloride溶液中也表現出較高的耐受性[10]。
三、奈米抗體新玩家
上面關於奈米抗體的描述中,我們列舉了很多ChromoTek的產品作為實例。沒錯,就是因為ChromoTek是奈米抗體領域的專家,在羊駝奈米抗體領域擁有多項世界前列的專利技術。
P.S. 關於ChromoTek的優秀技術,後續會專門出一篇文章,記得訂閱倍思特電子報
Proteintech完成對ChromoTek的全資收購,也標誌著Proteintech成為奈米抗體新玩家,正式進軍奈米抗體領域!相信傳統技術和新生技術的碰撞,一定可以擦出不一樣的火花!
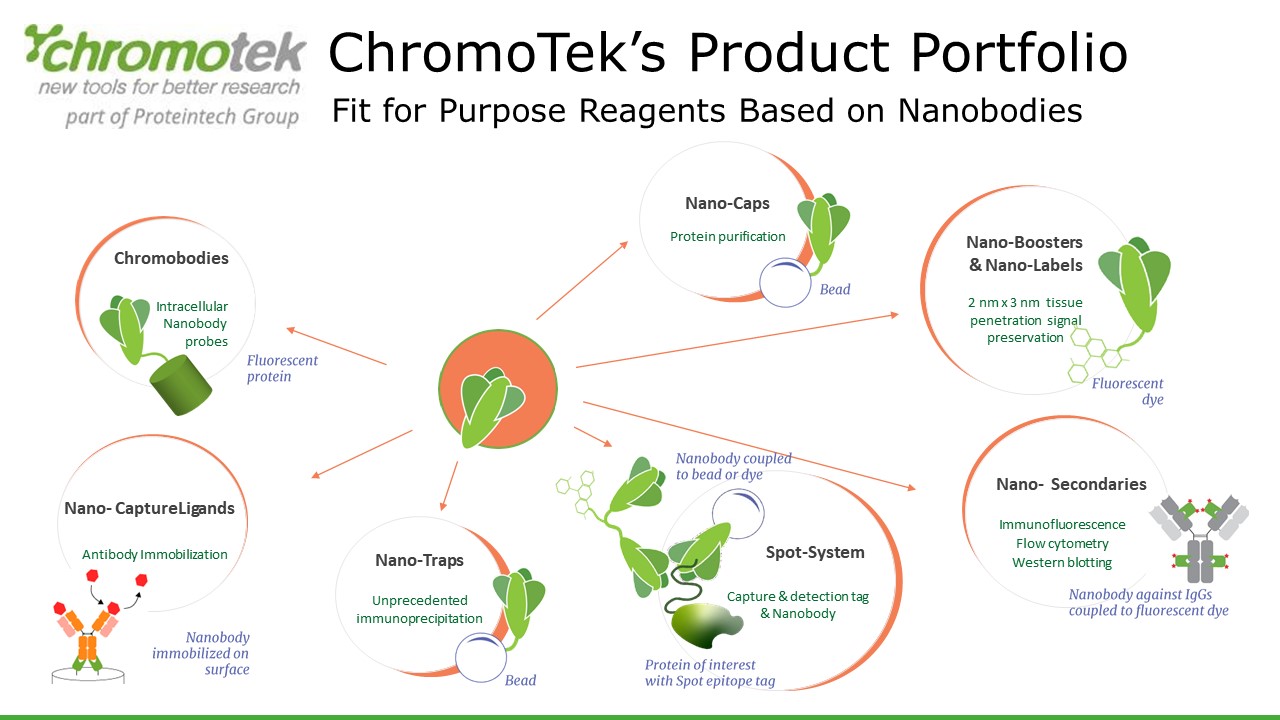
文章轉自Proteintech
.jpg)
引用文獻
[1] Skerra, A. and Pluckthun, A. (1988) Assembly of a functional immunoglobulin Fv fragment in Escherichia coli.Science (New York, NY), 240, 1038-1041.
[2] Hamers-Casterman, C., Atarhouch, T., Muyldermans, S., Robinson, G., Hamers, C., Songa, EB, Bendahman, N. and Hamers, R. (1993) Naturally occurring antibodies devoid of light chains. Nature, 363, 446-448.[3] Blanc, MR, Anouassi, A., Abed, MA, Tsikis, G., Canepa, S., Labas, V., Belghazi, M. and Bruneau, G. (2009) A one-step exclusion-binding procedure for the purification of functional heavy-chain and mammalian-type gammaglobulins from camelid sera. Biotechnology and Applied Biochemistry, 54, 207-212.
[4] Goyvaerts, C., Robays, L., De Groeve, K., Raes, G., De Baetselier, P., Thielemans, K. and Breckpot, K. (2010) Targeting lentiviral vectors to dendritic cells by the nanobody display technology. Human Gene Therapy, 21, 1440-1441.
[5] https://www.chromotek.com/products/detail/product-detail/chromobodies/
[6] Li, TF, Bourgeois, JP, Celli, S., Glacial, F., Le Sourd, AM, Mecheri, S., Weksler, B., Romero, I., Couraud, PO, Rougeon, F. and Lafaye, P. (2012) Cell-penetrating anti-GFAP VHH and corresponding fluorescent fusion protein VHH-GFP spontaneously cross the blood-brain barrier and specifically recognize astrocytes: Application to brain imaging. Faseb Journal, 26, 3969-3979.
[7] Coppieters, K., Dreier, T., Silence, K., de Haard, H., Lauwereys, M., Casteels, P., Beirnaert, E., Jonckheere, H., de Wiele, CV, Staelens , L., Hostens, J., Revets, H., Remaut, E., Elewaut, D. and Rottiers, P. (2006) Formatted anti-tumor necrosis factor alpha VHH proteins derived from camelids show superior potency and targeting to inflamed joints in a murine model of collagen-induced arthritis. Arthritis and Rheumatism, 54, 1856-1866.
[8] https://www.sciencemag.org/news/2018/05/mini-antibodies-discovered-sharks-and-camels-could-lead-drugs-cancer-and-other-diseases
[9] Liu, JL, Zabetakis, D., Brown, JC, Anderson, GP and Goldman, ER (2014) Thermal stability and refolding capability of shark derived single domain antibodies. Molecular Immunology, 59, 194-199.
[10] Dumoulin, M., Conrath, K., Van Meirhaeghe, A., Meersman, F., Heremans, K., Frenken, LGJ, Muyldermans, S.,Wyns, L. and Matagne, A. (2002) Single-domain antibody fragments with high conformational stability. Protein Science, 11, 500-515.
[11] Sheng Liu, Jing Li, Xingguo Liang, Huawei Xin.(2015) Research Advance in Single-Domain Antibody. QianRen Biology, 2(3), 26-38.
[12] Laura S. Mitchell, Lucy J. Colwell. (2017) Comparative analysis of nanobody sequence and structure data. Proteins. 86:697–706.

.png)
