【Proteintech】熱度不減的泛素化到底有什麼「魔力」?
【Proteintech】
『 熱度不減的泛素化 』 到底有什麼「魔力」?
蛋白質翻譯後修飾(Post-translational modification, PTM)是具有多種生物學功能的細胞蛋白質的重要調節機制之一。不同類型的修飾會對蛋白質的電荷狀態、疏水性、構象和穩定性產生不同改變,最終影響其功能。目前,最常見的修飾包括磷酸化、乙醯化、泛素化、糖基化、甲基化等。泛素化因參與了細胞週期、增殖、凋亡、分化、信號傳遞、損傷修復、發炎免疫等幾乎一切生命活動的調控而備受關注,近年來,有關於泛素化的研究也在不斷增多!
本期,小編帶大家一起了解下泛素化的相關知識。
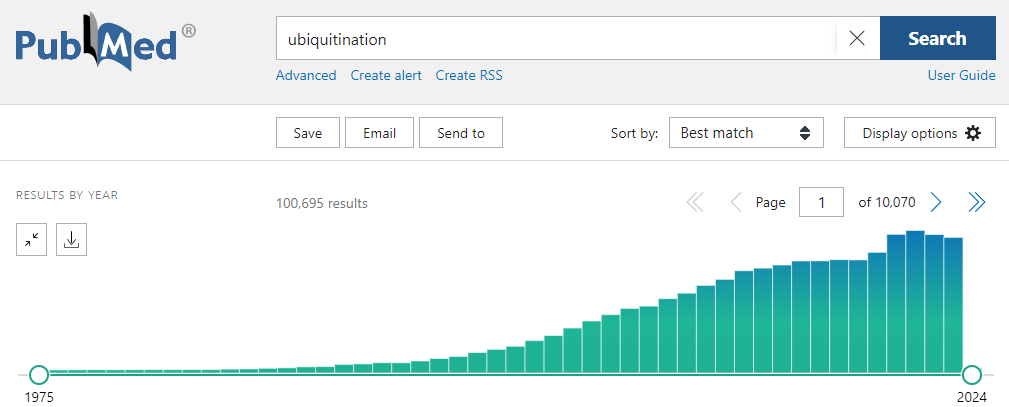
圖1 泛素化相關文章發表趨勢[源自於PubMed]
泛素化的基本概念
1. 泛素
泛素(Ubiquitin,Ub)於1975年首次被發現,是一種高度保守的具有76個氨基酸殘基(分子量約8.5kDa)的小蛋白,幾乎存在於真核生物的所有組織中。泛素的關鍵特徵在於它的7個離胺酸殘基(K6, K11, K27, K29, K33, K48和K63)都可以被泛素化,進而形成異胜肽連結的泛素鏈。當泛素附著在第二個泛素的N端時,就會產生第8種鏈類型,即Met1(M1)鏈。
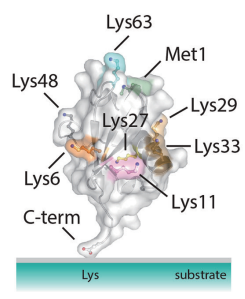
圖2 泛素的八個泛素化位點[1]
2. 泛素化
泛素化(ubiquitination)是真核細胞中十分重要的蛋白質轉譯後修飾過程,其最重要的功能為靶向底物蛋白被26S蛋白酶體降解,此外也可以透過改變蛋白質結構、功能、定位、組裝等參與細胞訊號傳導、細胞週期調控、DNA修復等多種功能。
泛素化過程由三種不同類型的酵素催化:泛素活化酶E1(ubiquitin-activating enzyme)、泛素綴合成酶E2(ubiquitin-conjugating enzyme)和泛素連接酶E3(ubiquitin ligase enzyme)。泛素化是可逆的,其相反的過程稱為去泛素化(Deubiquitination),由一類蛋白水解酶--去泛素化酶(Deubiquitination enzymes,DUBs)介導。
據報導,人類基因組編碼2種E1s,分別是UBA1(UBE1)和UBA6(UBE1L2),約40種E2s,約600-1000種E3s,以及100多種DUBs。
透過上述介紹,想必大家對泛素化有了初步的認知。下面,小編將透過其分子機制帶大家進一步去了解泛素化。
泛素化的分子機制
1. 泛素化修飾途徑
泛素化是一個動態的、高度調控的過程。首先,遊離泛素(Ub)分子被E1以ATP依賴的方式激活,透過硫酯鍵連接形成E1-Ub複合物;隨後,活化的Ub被轉移到E2的活性位點半胱氨酸(Cys)殘基上;最後,E2-Ub複合物與E3相互作用,促進活化的Ub轉移到底物蛋白的離胺酸(Lys)殘基上(見圖3)。
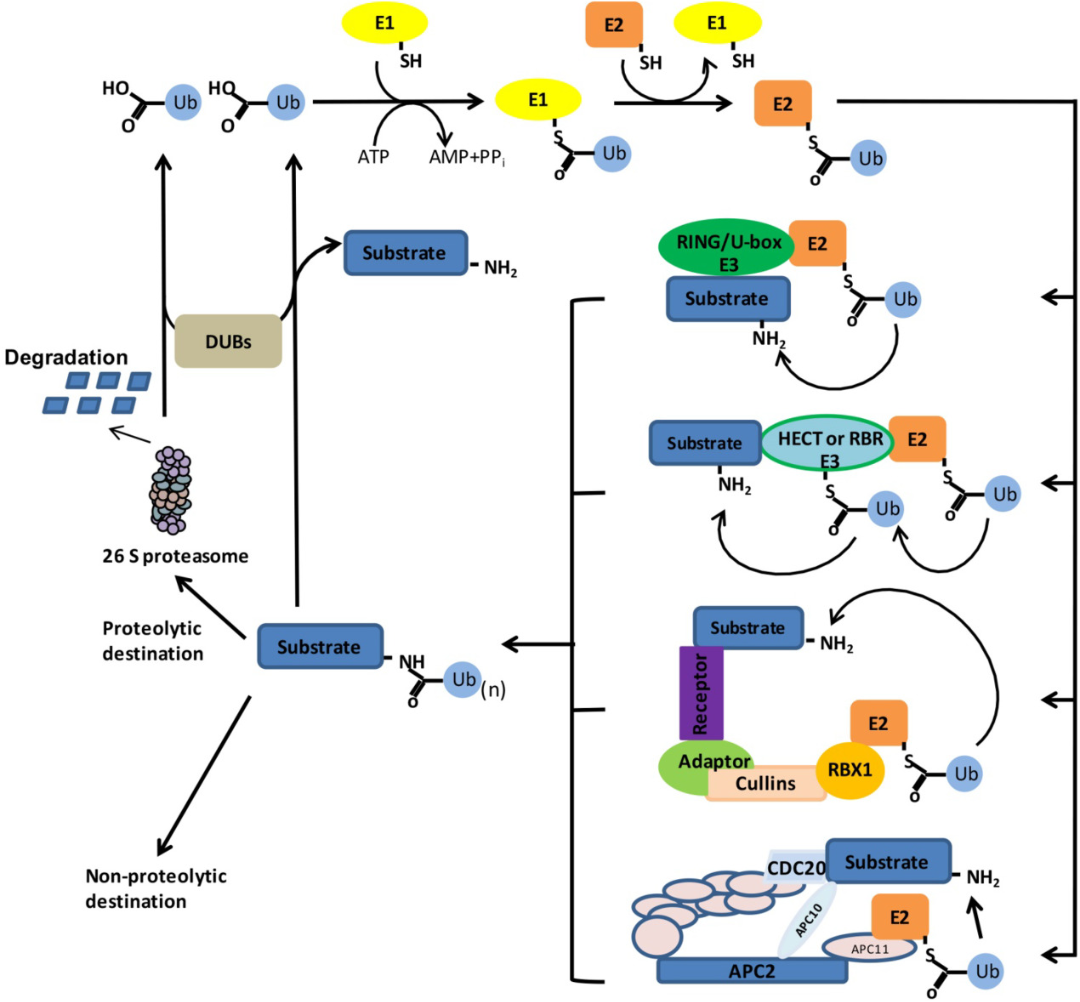
圖3 泛素化路徑[2]
值得一提的是,根據所涉及的E3類型,泛素可以直接從E2轉移到其底物(RING、U-box和Cullin-RING E3連接酶),也可以在轉移前與E3形成硫酯中間體(HECT和RBR E3連接酶)。在第一個泛素附著在底物上形成泛素鏈後,可以重複酵素級聯反應。泛素修飾的類型決定了底物蛋白的命運,被26S蛋白酶體降解或作為非蛋白被水解。 DUBs可催化Ub從結合底物中移除,並在泛素化底物降解後生成循環的泛素分子。
2. 泛素化的複雜性
大多數關於泛素化的研究都集中在與氨基的連接上,最初是在賴氨酸殘基上。如圖4所示,單泛素化(Monoubiquitination )是最簡單的泛素化形式,一個Ub分子可以附著在一個蛋白質上。或多個Ub單體可以同時附著在一個蛋白質中的幾個不同的離胺酸上--多單泛素化(Multimono-ubiquitination )。當然,Ub單體可以形成更複雜的結構,即與Ub的離胺酸殘基相連的泛素鏈,當這種情況發生時,它被稱為多泛素化(Polyubiquitination )。當一個特定的殘基將所有的Ub單體連接在一起時,該鏈就以此殘基命名,如K48鏈或K63鏈,這類為同型多泛素化(Homotypic polyubiquitylation )。多泛素化的Ub殘基決定了Ub鏈的結構,例如M1鏈和K63鏈採用類似於線性鏈的「開放」構象,而K48鏈具有緊湊的「之字形」球狀構象。同樣,也存在著混合鏈、分支鏈、類泛素修飾以及化學修飾等異型多泛素化(Heterotypic polyubiquitylation)。
除此之外,隨著研究不斷深入,內質網相關的降解、過氧化物酶體蛋白易位等其他過程涉及底物蛋白上半胱氨酸(Cys)、絲氨酸(Ser)或蘇氨酸(Thr)側鏈的非典型泛素修飾被報告。這說明,很有可能很大一部分泛素編碼仍然是未知的,未來還需要新的工具來識別其他類型的修飾,量化和表徵它們的功能。
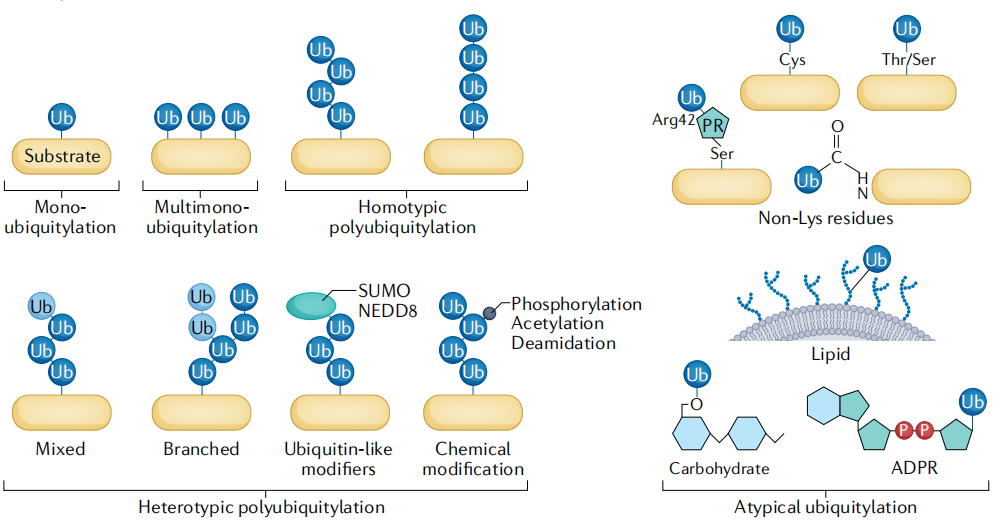
圖4 泛素編碼及其修飾[3]
在所有類型的多泛素鏈中,K48、K63是研究最廣泛的。經典的K48連接的泛素化靶向底物蛋白被蛋白酶體降解,而K63連接的泛素化廣泛參與訊號傳導和DNA損傷反應。其他六種類型的泛素化連結被稱為「非典型」泛素化。其中,M1鏈已被報告為訊號傳導的正調控因子,特別是在腫瘤、發炎和免疫等方面發揮重要作用;K6鏈與DNA修復有關,也可能調節粒線體穩態;K11鏈對細胞週期的調控至關重要;K29和K33鏈都已被證明可以調節先天免疫信號通路並誘導選擇性自噬;K27鏈因其對多種生理過程的不同作用而受到越來越多的關注,如線粒體自噬作用、蛋白酶體降解及訊號傳導等(圖5)。
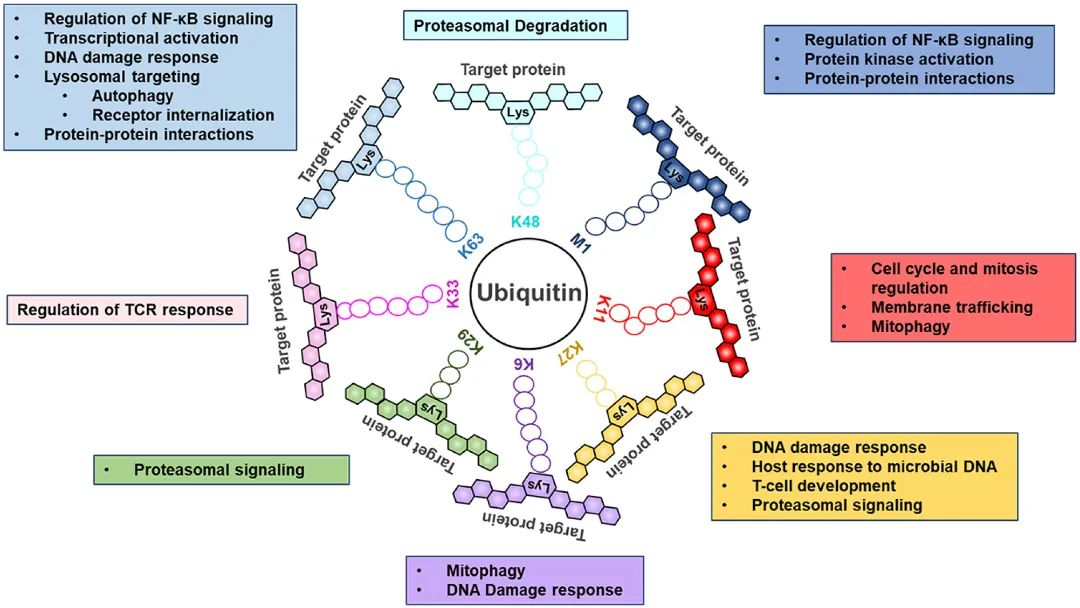
圖5泛素不同連接類型及其功能[4]
類泛素化修飾
除了泛素化修飾,細胞內還有一些與泛素化修飾相類似的反應,如SUMOylation(小泛素化修飾,SUMO化修飾)和NEDDylation等。
小泛素相關修飾物(small ubiquitin-related modifier,SUMO)是泛素類蛋白家族的重要成員之一,由98個胺基酸組成,在進化上高度保守,是類泛素蛋白(ubiquitin-like protein, UBL)中研究最多的一種。 SUMO1/2/3是主要的SUMO蛋白。在哺乳動物中,SUMO2是最豐富的家族成員,它對胚胎發育至關重要,可以彌補SUMO1和SUMO3的缺失。成熟的SUMO2和SUMO3的胺基酸序列幾乎相同,因此它們通常被稱為SUMO2/3。
SUMO化修飾類似但又不同於泛素化修飾(見圖6)。動態SUMO訊號在細胞週期進程、核體組裝、蛋白毒性壓力和免疫過程中非常重要,並進一步調節幾乎所有的核過程,包括基因表現、DNA損傷反應、RNA加工等。因此,SUMO酶可能成為治療人類疾病的藥物開發的標靶。
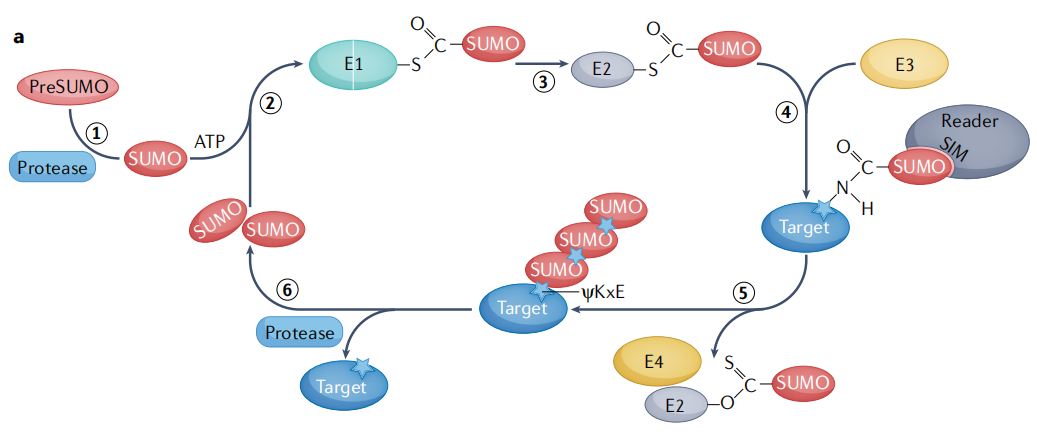
圖6 SUMOylation途徑[5]
NEDD8含有81個胺基酸,也是一種類泛素蛋白修飾分子,與泛素分子的一致性為59%,相似性高達80%,其相似程度是眾多類泛素分子中最高的。 NEDDylation的發生機轉也同泛素化相似(見圖7)。 NEDDylation可能參與細胞增殖分化、細胞發育、細胞週期、訊號傳導等重要生命過程的調控,NEDDylation異常會導致人類的神經退化性疾病和癌症。
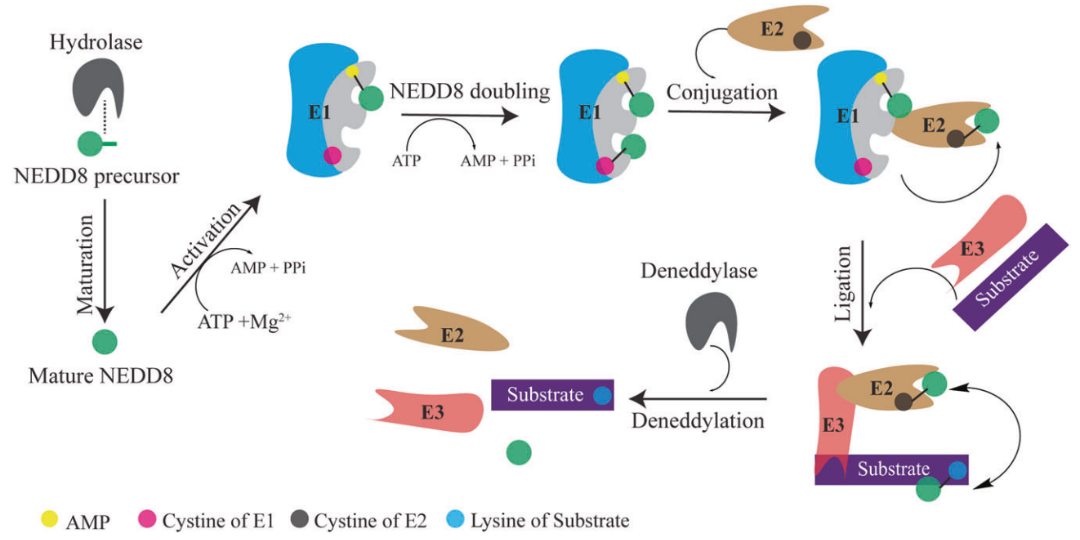
圖7 NEDDylation 途徑[6]
小結
泛素化最初被認為是一種降解蛋白質的方法。而隨著研究的不斷深入,泛素化現在被認為是用途最廣泛的蛋白質修飾系統,參與發炎動態調節和細胞程序性死亡等關鍵過程,幾乎影響生命科學的所有領域。泛素化受到許多酵素的嚴格調控,包括E1s, E2s, E3s和DUBs等。在許多疾病中,泛素調控異常已被廣泛報導,包括癌症和自體發炎性疾病等。相信隨著科學技術的不斷進步,研究人員可以更加深入地理解複雜的泛素系統,包括它在疾病過程中的作用,這對於泛素系統所涉及的各種疾病的治療具有重要意義。
泛素廣泛參與細胞各種生命活動,但由於泛素化的複雜性,目前人們對它的了解仍為冰山一角。以泛素化相關抗體為工具,透過表徵蛋白質水平、性質和變化規律,可幫助研究人員準確定位泛素化標靶和標靶相關疾病治療/藥物開發。
這裡,小編也整理泛素化相關的一些重要抗體、奈米抗體和試劑盒,希望對相關領域的研究帶來幫助!
| 類型 | 目標名稱 | 貨號 | 抗體類型 | 應用 | 物種 | SCI引用 |
| 泛素/類泛素蛋白 | Ubiquitin | 10201-2-AP | Polyclonal | WB, IHC, IF, FC, CoIP, ChIP, ELISA | Human, Mouse, Rat, Arabidopsis, Trypanosoma Cruzi, Monkey, Bovine | 352 |
| 80992-1-RR | Recombinant | WB, IP, IHC, IF, ELISA | Human, Mouse, Rat, Hamster, Dog, Spinach, Yeast | 4 | ||
| ISG15 | 15981-1-AP | Polyclonal | WB, IP, IHC, IF, CoIP, ELISA | Human, Mouse, Goat, Monkey, Pig | 49 | |
| E1 | UBE1 | 67198-1-Ig | Monoclonal | WB, IHC, IF, ELISA | Human, Mouse, Rat | 1 |
| 15912-1-AP | Polyclonal | WB, IHC, ELISA | Human, Mouse, Rat | 11 | ||
| UBA6 | 13211-1-AP | Polyclonal | WB, IP, IHC, IF, ELISA | Human, Mouse | 1 | |
| E2 | UBA2 | 15347-1-AP | Polyclonal | WB, IP, IHC, IF, ELISA | Human, Mouse | 1 |
| UBE2C | 66087-1-Ig | Monoclonal | WB, IHC, IF, ELISA | Human, Mouse, Rat | 7 | |
| 12134-2-AP | Polyclonal | WB, IP, IHC, IF, ELISA | Human, Mouse, Rat | 12 | ||
| E3 | Parkin | 66674-1-AP | Monoclonal | WB, IHC, IF, ELISA | Human, Mouse, Rat, Pig | 31 |
| 14060-1-AP | Polyclonal | WB, IP, IHC, IF, CoIP, ELISA | Human, Mouse, Rat, Chicken, Cattle, Ducks, Rabbit, Pig, Bovine | 201 | ||
| STUB1 | 29751-1-AP | Polyclonal | WB, ELISA | Human, Mouse, Rat | - | |
| CBL | 66576-1-AP | Monoclonal | WB, IHC, ELISA | Human | 2 | |
| 25818-1-AP | Polyclonal | WB, IP, IHC, IF, CoIP, ELISA | Human, Mouse | 13 | ||
| SUMO | SUMO1 | 67559-1-Ig | Monoclonal | WB, IP, IHC, IF, ELISA | Human, Mouse, Rat | 1 |
| 10329-1-AP | Polyclonal | WB, IP, IHC, IF, FC, CoIP, ELISA | Human, Mouse, Rat | 14 | ||
| SUMO2/3 | 67154-1-Ig | Monoclonal | WB, IHC, IF, ELISA | Human, Mouse, Rat | 1 | |
| 11251-1-AP | Polyclonal | WB, IP, IHC, IF, CoIP, ELISA | Human, Mouse, Rat | 11 | ||
| NEDD | NEDD8 | 16777-1-AP | Polyclonal | WB, IHC, IF, ELISA | Human, Mouse, Rat, Monkey | 4 |
| 去泛素化 | USP18 | 12153-1-AP | Polyclonal | WB, ELISA | Human | - |
| BAP1 | 10398-1-AP | Polyclonal | WB, IP, IHC, ELISA | Human, Mouse | 3 | |
| USP1 | 66069-1-Ig | Monoclonal | WB, IHC, ELISA | Human, Rat | - | |
| 14346-1-AP | Polyclonal | WB, IP, IHC, IF, CoIP, ELISA | Human, Mouse, Rat | 25 |
| 類型 | 產品名稱 | 貨號 | 應用 | 結合方式 |
| Ubiquitin VHH | ChromoTek Ubiquitin VHH, recombinant binding protein | ut | Conjugation | 非共軛結合 |
| Ubiquitin Nano-Trap | ChromoTek Ubiquitin-Trap Agarose | uta | IP, CoIP | 瓊脂糖珠 |
| ChromoTek Ubiquitin-Trap Agarose Kit | utak | IP, CoIP | 瓊脂糖珠 | |
| ChromoTek Ubiquitin-Trap Magnetic Agarose | utma | IP, CoIP | 磁珠 | |
| ChromoTek Ubiquitin-Trap Magnetic Agarose Kit | utmak | IP, CoIP | 磁珠 |
【參考文獻】
[1] Swatek KN, Komander D. Ubiquitin modifications. Cell Res. 2016 Apr;26(4):399-422. doi: 10.1038/cr.2016.39. PMID: 27012465.
[2] Zhou B, Zeng L. Conventional and unconventional ubiquitination in plant immunity. Mol Plant Pathol. 2017 Dec;18(9):1313-1330. doi:10.1111/mpp.12521. PMID: 27999.
[3] Dikic I, Schulman BA. An expanded lexicon for the ubiquitin code. Nat Rev Mol Cell Biol. 2023 Apr;24(4):273-287. doi: 10.1038/s41580-022-00543-1. .
[4] Mooney EC, Sahingur SE. The Ubiquitin System and A20: Implications in Health and Disease. J Dent Res. 2021 Jan;100(1):10-20. doi: 10.1177/0022034520949486.526.
[5] Vertegaal ACO. Signalling mechanisms and cellular functions of SUMO. Nat Rev Mol Cell Biol. 2022 Nov;23(11):715-731. doi: 10.1038/s41580-022-00500-y. PMID
[6] Mamun M, Liu Y, Geng YP, Zheng YC, Gao Y, Sun JG, Zhao LF, Zhao LJ, Liu HM. Discovery of neddylation E2s inhibitors with therapeutic activity. Oncogenesis. 2023 Sep 1612(1):12(1): 45. doi: 10.1038/s41389-023-00490-2. PMID: 37717015.
[7] Roberts JZ, Crawford N, Longley DB. The role of Ubiquitination in Apoptosis and Necroptosis. Cell Death Differ. 2022 Feb;29(2):272-284. doi:10.1038/s41418-021-0092-9.0092 PMID : 34912054.
[8] Zhou Q, Zhang J. K27-linked noncanonic ubiquitination in immune regulation. J Leukoc Biol. 2022 Jan;111(1):223-235. doi: 10.1002/JLB.4RU0620-397RR.
資料來源:Proteintech
這期倍思特小編分享的內容是不是覺得收穫滿滿呢~
感謝大家的關注和支持
下期見~
歡迎洽詢 業務專員 或 加入 ABreal 倍思特生技 Line@: @abreal
