Proteintech COVID-19 研究相關抗體引用文獻整理
Proteintech can help!
截止2020年5月27日,全球新冠肺炎確診人數已經突破569萬人;死亡人數高達352281人,已經成為21世紀以來人類所面臨的最嚴重的公共衛生事件。生命科學領域和醫學領域的科學家們正在爭分奪秒的對其進行研究,希望能夠通過科學的方法和手段來阻止這場浩劫蔓延。
Proteintech身為科學家們的忠實合作夥伴,有幸在震撼全球的“新冠戰役”中與科學家們併肩作戰,這次就要跟大家分享Proteintech產品在SARS-CoV-2 virus相關研究中的英勇身影。
SARS-CoV-2 virus的蛋白質結構可分為:S、M、E、N ,以下分別說明:
1. S-protein:Spike protein 是存在於SARS-CoV-2病毒粒表面有球棒狀的突出部分,由兩個功能性亞基組成,
S1用於受體結合,S2用於膜融合。S是I型跨膜蛋白,有大的胞外域(ectodomain)以及一個小的胞內域(endodomain)。2. M-protein:Membrane構成病毒的外膜,通過三個跨膜結構域嵌入病毒外膜里中。
3. E-protein:Envelope protein是小的跨膜蛋白,量少,促進病毒的組裝和釋放。
4. N-Protein: Nucleocapsid蛋白以串珠的形式結合到RNA基因組上,形成螺旋對稱的結構。
.png)
目前已知與SARS病毒類似,SARS-CoV-2也是通過病毒脂質膜上的S-protein識別人宿主細胞的受體ACE2。與受體結合後,刺突蛋白被某些蛋白酶(TMPRSS2和Furin)切割,以便與宿主細胞的膜融合。
SARS-CoV-2入侵細胞到繁殖複製的完整過程需要科學界投注更多的心力去發掘,另外感染SARS-CoV-2所導致的臨床症狀也需要一一釐清成因。
|以下分享Proteintech產品貢獻一份力量的相關研究:
.png)
許多新冠肺炎患者,包括感染但無其他症狀的患者,出現嗅覺喪失的症狀,但這症狀的成因機制尚不清楚。此研究的團隊利用小鼠模型,使用RNAseq,RT-PCR,原位雜交,WB和ICC等方法來確定嗅覺上皮細胞是否表達SARS-CoV-2病毒進入宿主細胞的相關受體。
研究發現細胞表面蛋白ACE2和蛋白酶TMPRSS2在嗅覺上皮細胞(支持細胞)中有較高表達,且ACE2蛋白的積累量也比呼吸道上皮細胞高(下圖C);另隨年齡增長,ACE2蛋白會在小鼠嗅覺上皮細胞中增加(下圖AB)。
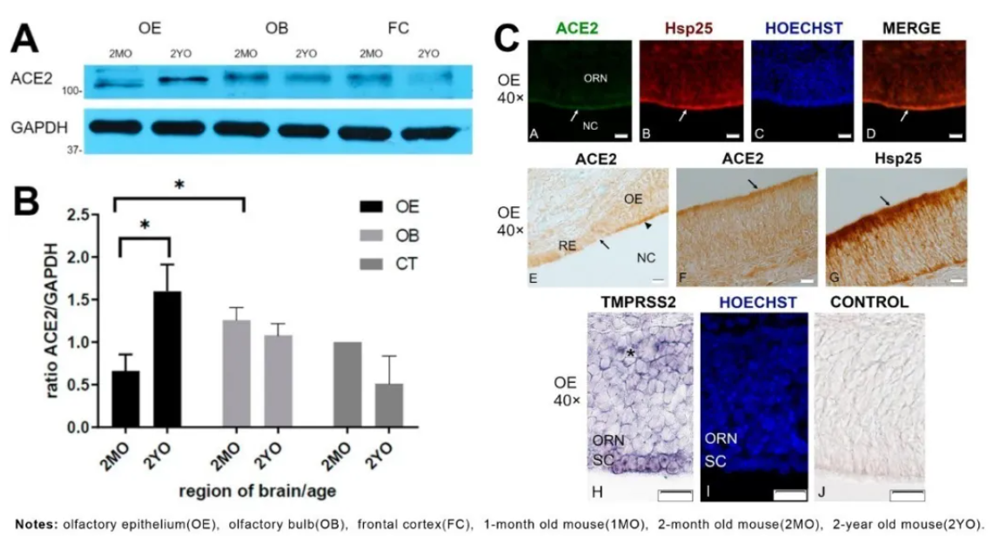
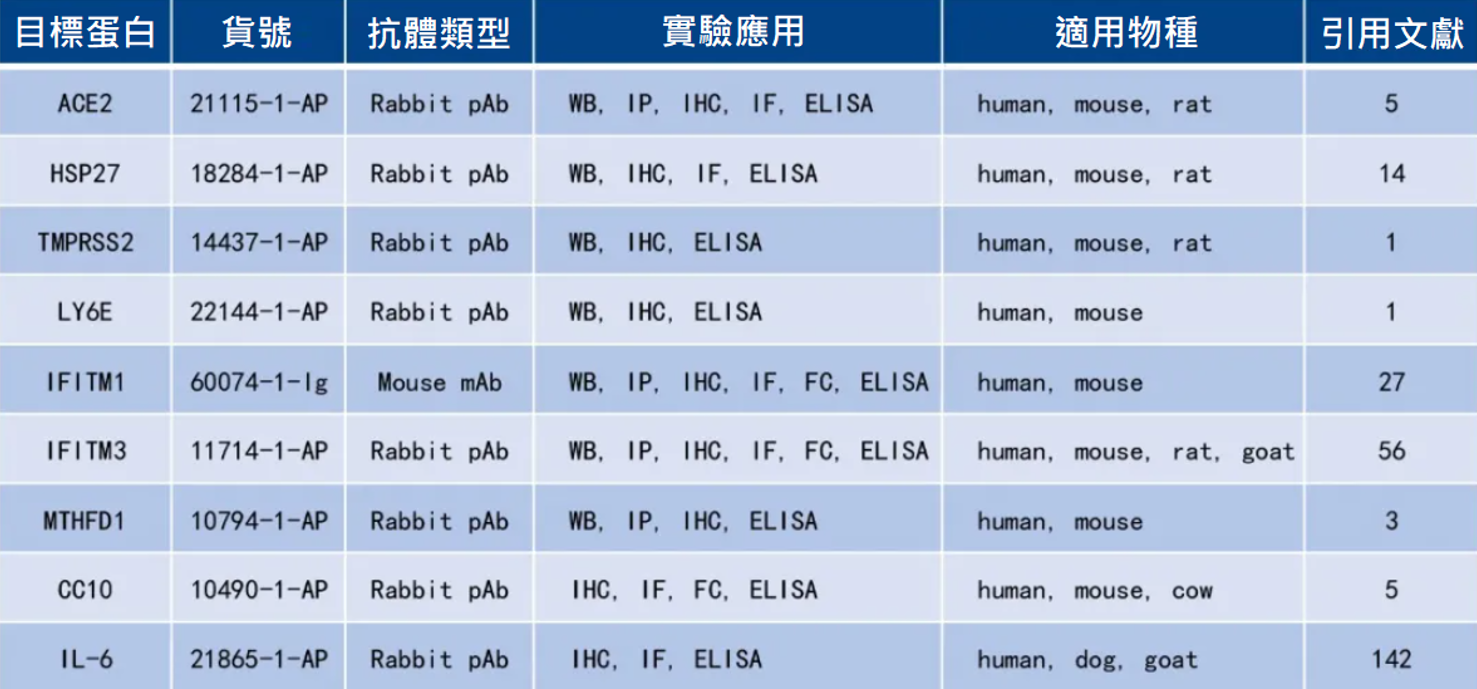
此篇研究中用於偵測ACE2蛋白含量的關鍵抗體ACE2 Antibody(21115-1-AP) 和 HSP27 Antibody(18284-1-AP)。
.png)
部分研究結果顯示,感染新冠肺炎的發病率與死亡率,男性均高於女性。有觀點認為該現象可能是由於雄激素調節肺部TMPRSS2蛋白的表達機制所驅動,本研究針對該觀點做了進一步的探討。
研究發現人體內,TMPRSS2的mRNA水平不隨性別而變化(下圖A);同時在雄性小鼠中,用雄激素受體拮抗劑enzalutamide治療不會降低肺部TMPRSS2表達;但是研究人員也發現小鼠肺部雄激素受體(Ar)的表達在雄性小鼠與雌性小鼠之間有明顯差異,二者Ar轉錄水平相同,但是雄性小鼠肺部Ar蛋白水平明顯高於雌性小鼠(下圖BC)。
.png)
%20(1).png)
此篇研究中用於偵測TMPRSS2蛋白含量的關鍵抗體TMPRSS2 Antibody(14437-1-AP)。

C3A是人肝母細胞瘤HepG2細胞系的一個subclone,研究團隊偶然發現C3A比HepG2更易感染人冠狀病毒HCoV-OC43,隨後利用ADAP2、GILT和LY6E,三種已知能夠干擾病毒進入細胞的活性蛋白,展開了相關研究。
實驗發現在HEK293細胞中的過表達LY6E,可抑制人冠狀病毒HCoV-OC43的進入宿主細胞,而過表達GILT或ADAP2則不行;在C3A和A549細胞中LY6E的過表達有效地抑制了HCoV-OC43的感染,在HepG2中LY6E敲低也大大增加了其對HCoV-OC43感染的易感性(下圖CD)。
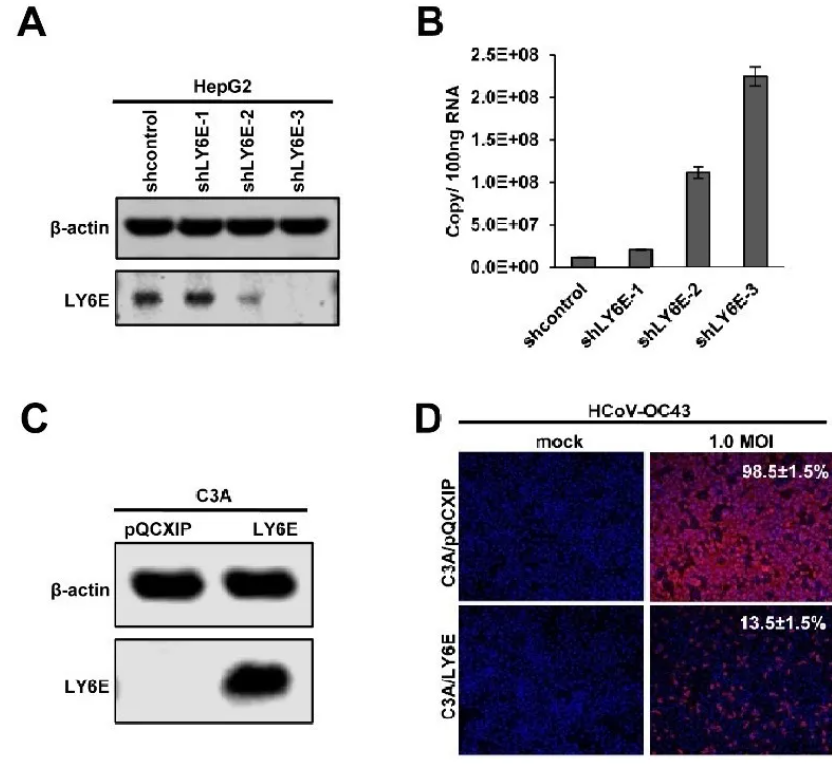

此外,研究團隊還發現LY6E有效限制,由其他人類冠狀病毒的S蛋白(包括SARS-CoV-2)介導的進入。並且,蛋白酶TMPRSS2過表達或AmphoB治療能顯著中和抗病毒因子IFITM3對人類冠狀病毒進入的限制,但並沒有抑制LY6E的相關功能(下圖A-B)。
綜上所述,該研究表明LY6E是一種關鍵的抗病毒免疫效應器,並通過獨特的機制控制冠狀病毒感染和發病機制。

.png)
此篇研究中用於偵測LY6E蛋白含量的關鍵抗體LY6E Antibody(22144-1-AP)、IFITM1-Specific Antibody(60074-1-Ig) 以及IFITM3 Antibody(11714-1-AP)。

研究團隊對蝙蝠細胞的兩萬多個基因進行系統性的全面篩查,確定了數十個病毒複製所依賴的關鍵蝙蝠基因,並發現了一個與人類共同的新的宿主基因MTHFD1。
蝙蝠MTHFD1表達水平比人類相應組織的細胞要低很多,這可能和蝙蝠適應飛行生活的生理變化有關。 MTHFD1抑製劑Carolacton強力阻止了包括SARS-CoV-2在內的幾種RNA病毒的複制(下圖AD),進一步說明MTHFD1是廣譜RNA病毒的關鍵宿主因子,可作為廣譜抗病毒藥物的靶標。
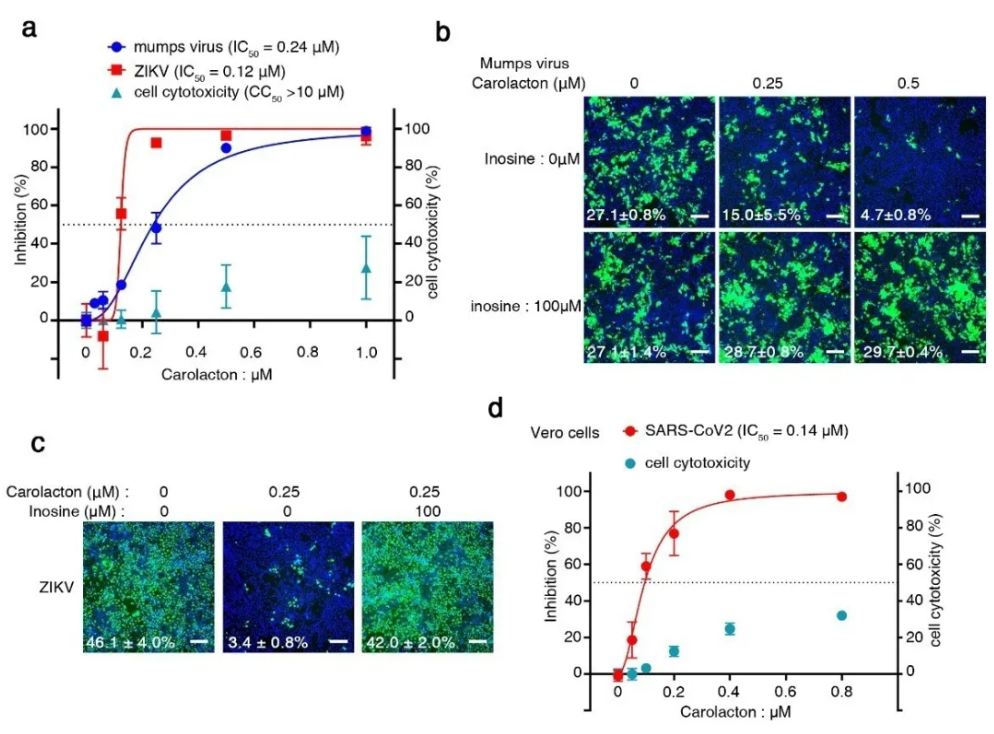

此篇研究中用於偵測MTHFD1蛋白含量的關鍵抗體MTHFD1 Antibody(10794-1-AP)。

研究團隊從一名確診為COVID-19的患者中分離出SARS-COV-2病毒,並與SARS-CoV、MERS-CoV和H1N1pdm的病毒嗜性和複製能力進行比較,評估SARS-CoV-2在人呼吸道、結膜和先天免疫反應中的組織和細胞的病毒嗜性,為研究SARS-CoV-2的發病機制提供了重要的觀點。
實驗數據顯示,SARS-CoV-2可感染支氣管上皮、肺Ⅰ型肺細胞和結膜粘膜的纖毛、粘液和club細胞(下圖A-B)。
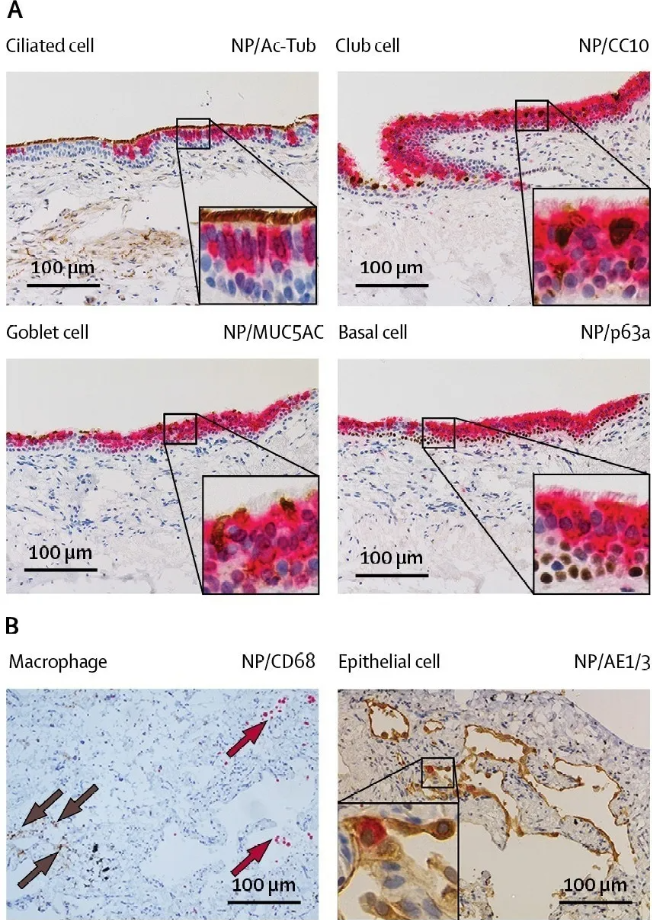

並在支氣管中,SARS-CoV-2複製能力與MERS-CoV相似,高於SARS-CoV,但低於H1N1pdm;而在肺中,SARS-CoV-2的複制能力與SARS-CoV和H1N1pdm相似,但低於MERS-CoV;在結膜中,SARS-CoV-2複製能力大於SARS-CoV。
與H5N1、H1N1pdm或MERS-CoV相比,SARS-CoV-2是一種較弱的促炎細胞因子誘導劑(下圖A-F)。

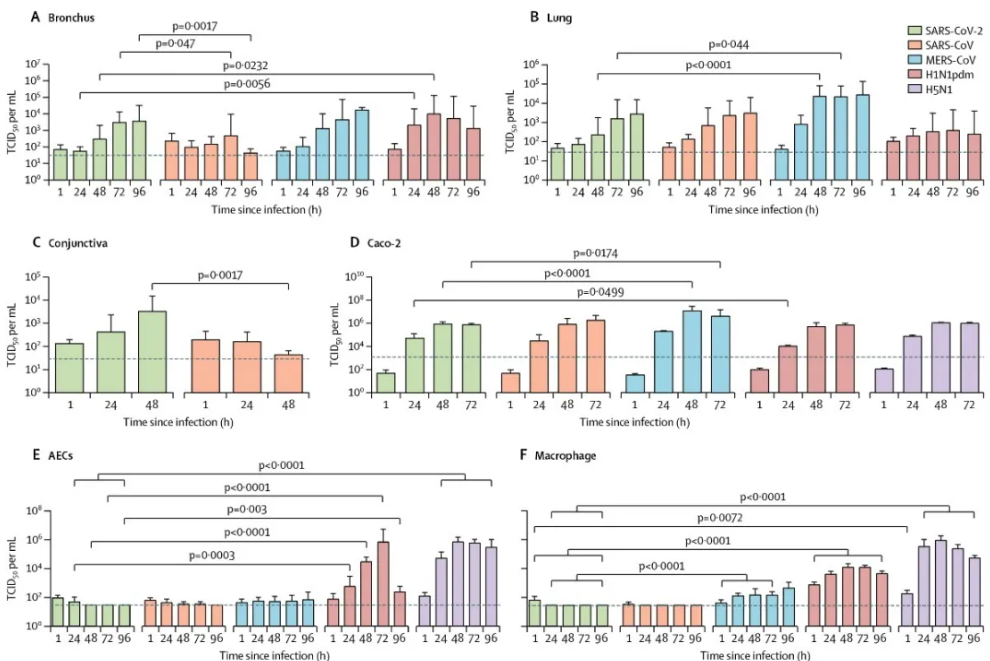
此篇研究中使用Uteroglobin/CC10 Antibody (10490-1-AP)。

研究團隊在一個早期沒有肺症狀史的SARS-CoV-2感染者中發現,SARS-CoV-2的複制和細胞病變效應會導致局部肺損傷(下圖A-E)。
說明了早期有效的抗病毒治療的潛在好處,可以防止進展為嚴重和致命的肺炎。並且,該研究還指出IL-6的局部生成還可能與肺損傷的炎症成分有關。

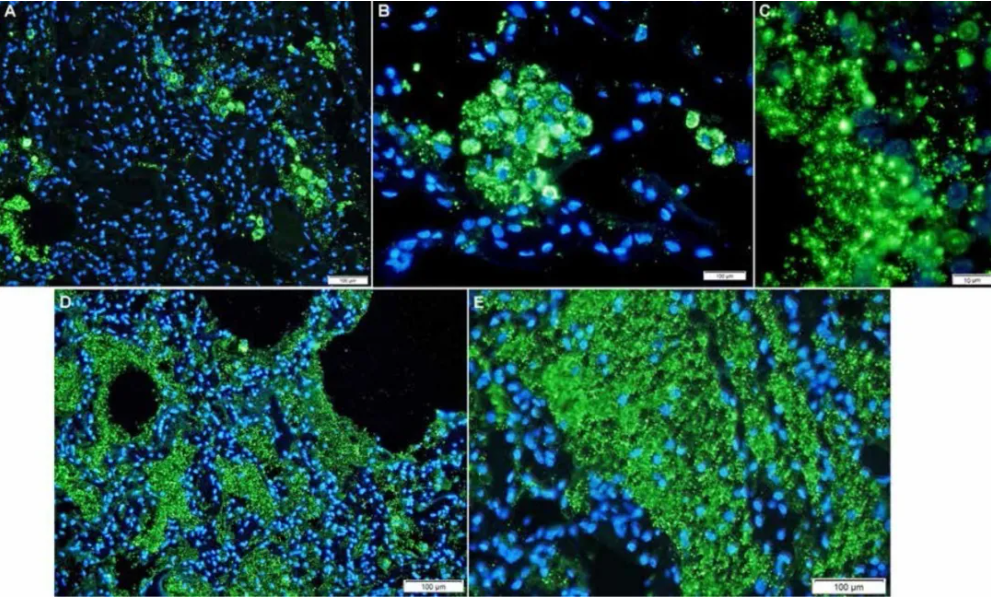
此篇研究中使用 IL-6 Antibody (21865-1-AP)。
.png)
SARS-CoV-2感染不僅導致肺損傷,同時也會造成嚴重的併發症,包括心臟、腎臟等重要器官的嚴重受損甚至衰竭,而ACE2是已知SARS-CoV-2入侵過程中的關鍵性細胞表面受體,研究團隊希望通過一種高通量的藥物篩選策略來發現一些能夠降低ACE2在心臟細胞表達的藥物。
通過一連串小分子篩選以及相關基因表達譜分析,研究團隊發現雄激素信號通路是ACE2水平的關鍵調控因子(AG),並且臨床數據也表明雄激素水平的異常與COVID-19患者嚴重的並發症和心肌損傷有顯著的相關性。
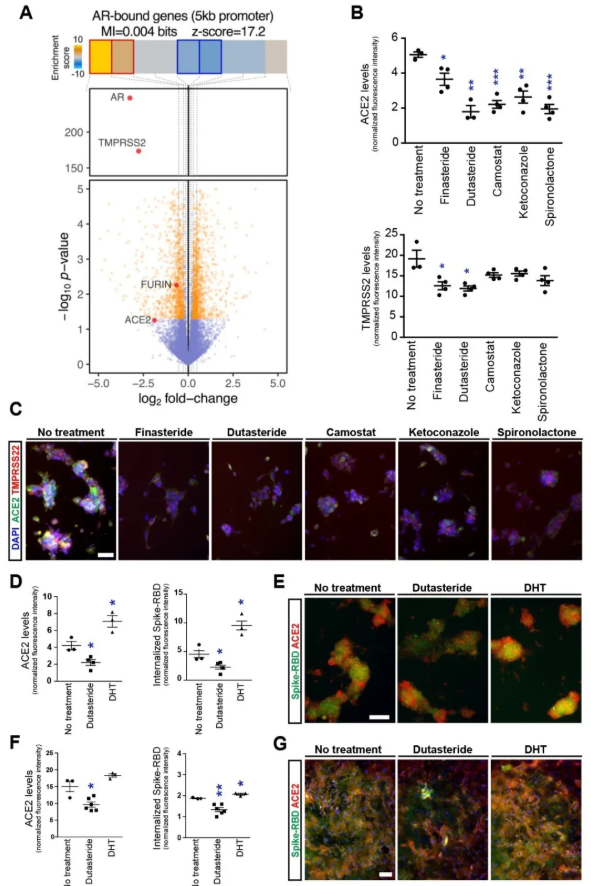

此篇研究中使用ACE2 Antibody(21115-1-AP)。
與新冠肺炎的戰鬥仍未結束,一線的你們需要繼續戰鬥,破解新冠病毒的防禦;後勤的我們需要開發出更多、更好的工具為你們提供援助。 2020,共勉前行!
更多 SARS-CoV-2 coronavirus 相關產品
本文編改自Proteintech官方文章
|更多Proteintech文章

.jpg)
.png)


.png)
.PNG)
.PNG)


