〔技術提示〕 低分子量蛋白質老是壓不到怎麼辦? 老師我不想努力了。。。

|重點提示|
Tris‑Tricine Buffer System v.s. Glycine-SDS-PAGE
Transfer 的時間控制
Transfer濕式與半乾式的選擇
膜的選擇和孔徑 0.45μm vs 0.2 μm
膜的選擇 PVDF v.s. NC膜
▼ 如何使用西方墨點法 (以下簡稱WB) 檢測低分子量(LMW)蛋白質?
SDS-PAGE和WB是常被用於檢測分子量界於約30 - 250 kDa蛋白質的實驗技術。
但這個技術的極限出現在分子量分層的最底部:分離效率差、信號減弱、甚至完全沒有你要看的Target Band。
低分子量的蛋白質(泛指分子量小於20 kDa的蛋白質),因為容易受到分辨率和保留率差的影響而造成沒有看到你要看的Target Band。
使用標準SDS-PAGE和WB來檢測它們相當具有挑戰性,但並非不可能。處理這些如羽毛般輕盈的嬌客時,可以採用幾種方法改良實驗流程,在SDS-PAGE保留它們並於後續的WB中提高分辨率。
▼ 嘗試Tricine
上面提到的「標準」聚丙烯酰胺凝膠(polyacrylamide gels)是指單一濃度的Glycine-Tris(簡稱為甘氨酸凝膠),通常只要適當地調整丙烯酰胺(Acrylamide)的百分比含量(T%),Glycine-Tri gel(簡稱為甘氨酸凝膠)是上述範圍。
30-250 kDas內任何蛋白質的理想實驗選擇(大約8%適用於檢測此範圍內的較高分子量的蛋白,針對較低分子量的則提高至16%,甚至18%),但如果您的目標條帶低於30 kDa,則利用Tris‑Tricine緩衝液系統所製作的丙烯酰胺凝膠會提高看到目標條帶的機會。
當您在Glycine-Tri gel(甘氨酸凝膠)上看到一條帶在預期的分子量附近模糊地徘徊時,預期換成Tricine系統膠體的結果中會看到幾個分佈在不同分子量、良好分辨的條帶。
您可以在Proteintech的Western Blotting完整指南中找到15%Tricine凝膠的配方。
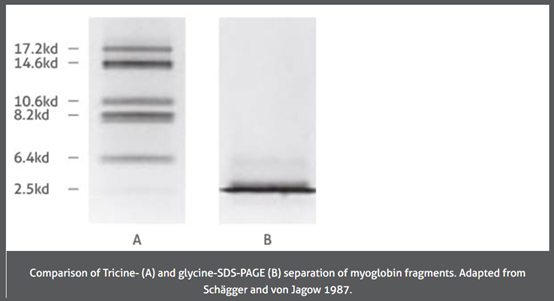
照片取自Schägger和von Jagow 1987.
比較肌紅蛋白(A)Tris‑Tricine buffer system 和(B)glycine-SDS-PAGE 跑膠時的差異。
Glycine和Tricine膠體的分離率差異歸因於Glycine和Tricine化合物的不同,例如pK值和離子移動率。這裡不做過多的介紹,大致歸納Tricine膠體更適合用於分離低分子量(LMW) 蛋白質的基本原因是;它與Glycine的堆疊方式 (Stacking) 不同。
堆疊的目的是將蛋白質打包成均勻的條帶,以便蛋白質組「同時」進入分離層-就像跑步者在比賽開始前在起跑線上排隊一樣。
例如:當蛋白質未完整被打包“推疊”之前就進入分離層,可能會出現條帶拖尾的現象。
Tricine膠體的堆疊層(stacking layer )可以有效推疊的最大蛋白質分子量上限為30 kDa,即小於30 kDa的蛋白質在到達分離層(separating layer)之前,就已經與大於30 kDa的蛋白質堆分離,此現象可以防止分離層界面處的過載,從而使低分子量(LMW)蛋白質能更有效地分離1。另Tricine膠體具有更高的離子移動率,這也意味著可以使用較低百分比的丙烯酰胺達成相同程度的分離;而更高濃度的丙烯酰胺濃度可解決低分子量(LMW)蛋白質的技術瓶頸,例如15% Tricine凝膠的範圍為5至20 kDa。
但若您需要分析低於5 kDa的目標呢?
在凝膠混合中添加6 M尿素可進一步提高小蛋白的分離度2,此法推薦用於5 kDa以下的任何目標蛋白。
▼ Protein Transfer (蛋白質的轉漬)
除了確保分離低分子量(LMW)蛋白質,您還需要在轉漬的階段多加注意。低分子量(LMW)蛋白質容易發生“過度轉漬”的現象:由於轉移膜缺乏保留或轉漬速率過快而導致樣品流失。
▼ 膜的選擇和孔徑
大多數實驗室可能會有慣用的轉漬膜,可能是硝酸纖維素 (nitrocellulose) 膜或聚偏二氟乙烯(PVDF),但對於較小的低分子量(LMW)蛋白質,PVDF是更好的選擇。
與硝化纖維素相比,它與蛋白具有更強的結合能力。3PVDF的蛋白結合能力為170-200 μg/ cm 2, 而硝酸纖維素的蛋白結合能力為80 -100μg/ cm2。
文獻3討論了在選擇用於WB的膜時應考慮的注意事項,並附有PVDF和硝化纖維素膜的微觀結構圖像(部分解釋了PVDF的蛋白質保留特性稍高) 。
請注意:無論哪種膜,都有各種孔徑可選擇。兩種膜都有0.45μm、0.2μm或0.1μm的版本。較小孔徑的膜有助於更有效地轉移漬低分子量(LMW)蛋白質。
0.2μm的膜足以用於重量小於20 kDa的任何蛋白,Proteintech實驗室使用Millipore的 Immobilon PSQ PVDF膜來轉移低分子量(LMW)蛋白質。
▼ Transfer condition (轉漬條件)
除選擇適合的膜之外,處理低分子量(LMW)蛋白質時,其他因素如:系統、時間、溫度和緩衝液組成,也會影響。針對低分子量(LMW)蛋白質,半乾式系統似乎優於濕式系統(可能基於簡單的事實:半乾式系統不太容易形成過度轉漬)。但是請注意,半乾式系統可能會遇到數據再現性的問題(但以低分子量(LMW)蛋白而言應該不是個大問題)。
對於低分子量(LMW)蛋白質,時間和電壓(或安培數,則取決於您的設置)往往需要減少,調整的多寡則取決您的實驗經驗與所使用系統的品牌和型號。
設備手冊通常會提供針對小於30 kDa的蛋白質的建議傳輸時間和電壓。
▼ 其他提示
您可能在樣品的緩衝液中使用了溴酚藍(bromophenol blue),但要注意某些蛋白質會脫離染料!
或者在準備轉漬之前,您可以選擇將完成電泳的膠體浸泡在不含SDS的緩衝液中5分鐘(或最簡單的就使用H2O);這個步驟有助於去除使蛋白質帶負電荷的SDS,從而增加了蛋白轉漬的效率。
最後祝大家實驗順利!
References
1. H Schägger and G von Jagow. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Anal Biochem. 1987;166(2):368-79
2. H Schägger, Tricine-SDS-PAGE, Nature Protoc. 2006;1(1):16-22.
3. The Protein Man’s Blog, PVDF or Nitrocellulose – Which Membrane is Best? Nov 12, 2014:http://info.gbiosciences.com/blog/bid/203026/PVDF-or-Nitrocellulose-Which-Membrane-is-Best

.jpg)
.png)
